
产品货号:
GS0054
中文名称:
柱式质粒DNA小量抽提试剂盒(1.5~5mL)
英文名称:
SgPrep Column Plasmid Mini-Preps Kit(1.5-5mL)
产品规格:
50次|100次
发货周期:
1~3天
产品价格:
询价
本试剂盒采用了一种新型的吸附材料,新吸附柱拥有良好的流速、超强的DNA结合能力和优秀的洗脱效率。改良的配方使试剂盒的菌液裂解能力、DNA与吸附柱的结合能力大大加强,新型裂解染料Visualysis的加入让裂解过程变得可视、可控,实现质粒得率最大化。对于高拷贝质粒,从6mL过夜菌液(OD600=2.0)中可以获得超过35μg的质粒DNA。操作过程快速、方便,无需使用酚/氯仿抽提,无需乙醇沉淀,整个抽提过程可以在20分钟内完成。由本试剂盒抽提得到的质粒纯度高,OD260/OD280比值一般在1.8~1.9之间,OD260/OD230比值大于2.0,可直接用于转化、DNA测序、PCR、基于PCR的突变、体外转录、酶切等后续实验。

- 使用新型吸附柱材料,吸附容量大,洗脱效率高。
- 新型裂解染料Visualysis让裂解过程可视化,实现质粒得率最大化。
- 操作过程快速、方便,无需使用酚/氯仿抽提,无需乙醇沉淀,全过程可在30分钟内完成。

| 组分 | 50次 | 100次 |
| Buffer P1 | 14mL | 28mL |
| Buffer P2 | 14mL | 28mL |
| Buffer P3 | 20mL | 40mL |
| 去蛋白液DW1 | 25mL | 50mL |
| 洗涤液WB | 12mL | 24mL |
| 洗脱液EB | 5mL | 10mL |
| RNase A | 210μL | 420μL |
| Visualysis | 60μL | 120μL |
| 吸附柱及收集管 | 50套 | 100套 |
保存:常温(18~25℃),RNase A收到后,请及时置于2~8℃保存,长期贮存请于-20℃放置。

- 加入RNase A后,Buffer P1请存放于2~8℃,有效期为半年。其他组分可于室温存放—年,长期存放请置于2~8℃。
- Buffer P3和去蛋白液DW1中含有刺激性的化合物,操作过程中应穿上实验服,戴好乳胶手套,避免沾染皮肤、眼睛和衣服,防止吸入口鼻。沾染皮肤或眼睛后,请立即用清水或生理盐水冲洗,必要时寻求医生的帮助。

- 准备工作。
□ 检查Buffer P1中是否已经加入RNase A。
□ 检查洗涤液WB中是否已经加入无水乙醇。
□ 检查Buffer P2和P3是否出现沉淀。 - 取1.5~5mL过夜培养的菌液,8000g离心2分钟收集菌体,弃尽培养基。
- 在沉淀中加入250μL Buffer P1,彻底悬浮菌体。
- 加入250μL Buffer P2,立即温和颠倒离心管5~10次混匀。室温静置2~4分钟。
- 加入350μL Buffer P3,立即温和颠倒离心管5~10次混匀。
- 12000g离心5~10分钟。将上清液移入吸附柱,8000g离心30秒,倒掉收集管中液体。
- (选做)加入500μL去蛋白液DW1,9000g离心30秒,倒掉收集管中液体。
- 加入500μL洗涤液WB,9000g离心30秒,倒掉收集管中液体。
- 重复步骤8一次
- 空吸附柱9000g离心1分钟。
- 将吸附柱放入—个干净的1.5mL离心管中,在吸附膜中央加入50~100μL洗脱液EB,室温静置1分钟后,离心1分钟。保存管中DNA溶液。

准备工作:
- 自备材料:小型高速离心机(最大离心力≥12000g)、1.5mL离心管、无水乙醇等。
- 试剂盒初次开启,将RNase A溶液全部加入Buffer P1中,混匀后在瓶身做好标记。储存于2~8℃,有效期为6个月。
- 按瓶身标签说明在洗涤液WB中加入相应量的无水乙醇(乙醇终浓度为80%),混匀后在瓶身做好标记。于室温密封保存。
- 每次使用前请检查Buffer P2和Buffer P3是否出现沉淀,如有沉淀,请于37℃溶解沉淀,待冷却至室温后使用。
操作步骤:
- 在含合适抗生素的培养基中接种目标菌株,于37℃摇床充分振荡培养12~16h。
- 菌液状态对质粒得率非常关键,请用不超过容器容量1/4体积的培养基进行培养。
- 处于生长平台期的茵体用于质粒拍提得率最禹,过度培养可能导致DNA降解。
- 菌液状态对质粒得率非常关键,请用不超过容器容量1/4体积的培养基进行培养。
- 对于离拷贝质粒,取1.5~5mL菌液,室温,8000g离心2min收集菌体,倒尽或吸干培养基。
- 对于高拷贝质粒,从5mL过夜菌液中通常可以获得超过20μg质粒DNA,不推荐使用更大的菌液量。
- 对于低拷贝质粒,如果使用更多的菌液,则同一个样品分多管收集,每管不超过5mL,分别裂解,合并同—个样品的各管裂解液通过同—个吸附柱来获得更高的得率。
- 对于高拷贝质粒,从5mL过夜菌液中通常可以获得超过20μg质粒DNA,不推荐使用更大的菌液量。
- 在菌体沉淀中加入250μL Buffer P1,吸打或振荡至彻底悬浮菌体。
- Buffer P1首次使用时请检查是否已加入RNase A。
- —定要彻底悬浮菌体,否则影响得率和质量。
- 如果使用Visualysis,则在加入250μL P1后再加入1μL Visualysis,振荡混匀。
- Visualysis需在临用前加入,直接加入到Buffer P1中出现浑浊为正堂现象。
- Buffer P1首次使用时请检查是否已加入RNase A。
- 加入250μL Buffer P2,立即温和颠倒离心管5~10次混匀,室温静置2~4min。
- 裂解时间与菌量相关,菌量多则适当延长时间,最长不能超过5分钟。
- 如果同时操作多个样品,每加入—管混匀—管,不要采用全部加入—起混匀的方法,计时从第—管样品加入开始。
- 如果使用了Visualysis,则溶液呈现均匀的蓝色表示混匀良好,如果出现白色团块,则提示菌体可能过量,宜选用更少的菌液重新开始。
- 裂解时间与菌量相关,菌量多则适当延长时间,最长不能超过5分钟。
- 加入350μL Buffer P3,立即温和颠倒离心管5~10次充分混匀。
- 如果同时操作多个样品,每加入—管混匀—管,不要采用全部加入—起混匀的方法。
- 加入Buffer P3后,离心管中会立即出现大量白色絮状沉淀,如果使用了Visualysis,则溶液由蓝色重新变为无色,有蓝色残留提示混匀不彻底,继续混合至蓝色全部消失。
- 如果起始菌液较多,混匀后室温静置2分钟以彻底去除RNA。
- 如果同时操作多个样品,每加入—管混匀—管,不要采用全部加入—起混匀的方法。
- 于离心机最大转速(≥12000g)离心5~10min,将上清全部小心移入吸附柱,9000g离心30sec。倒掉收集管中的液体,将吸附柱放入同—个收集管中。
- 吸附柱的最大有效容积为750μL,如果裂解液较多,可以重复该步骤直到至所有裂解液流过吸附柱。
- (可选步骤)在吸附柱中加入500μL去蛋白液DW1,9000g离心30sec。倒掉收集管中的液体,将吸附柱放入同—个收集管中。
- 对于End A+宿主菌,如BL21,HB101,JM系列等,此步不能省略。
- 对于End A-宿主菌,如DH5α,TOP10等,此步可以省略,但进行该步骤可进—步降低蛋白残留量。
- 对于End A+宿主菌,如BL21,HB101,JM系列等,此步不能省略。
- 向吸附柱中加入500μL洗涤液WB,9000g离心30sec。倒掉收集管中的液体,将吸附柱放入同—个收集管中。
- 洗涤液WB首次使用前请检查是否已加入正确最的无水乙醇。
- 重复步骤8一次。
- 将空吸附柱和收集管放入离心机,9000g离心1min。
- 此步绝不可省略,否则残余的乙醇会严里影晌得率和后续实验。
- 在吸附膜中央加入50~100μL洗脱液EB,室温静置1~2min,9000g离心1min。将所得到的质粒DNA溶液置于-20℃保存或用于后续试验。
- 洗脱液EB为2.5mM Tris-HCl,pH8.5,可以用TE或水(pH>7.0)代替。
- 将洗脱液EB预热至60℃可以进一步提高得率。
- 如果质粒>8kb,加入洗脱液EB后,在37~60℃温浴2分钟可以显著提高得率。
- 使用小于40μL的洗脱液可以得到浓度更高的DNA,但得率显著降低。
- 洗脱液EB为2.5mM Tris-HCl,pH8.5,可以用TE或水(pH>7.0)代替。

- 未提出质粒或质粒得率较低
- 大肠杆菌老化:请涂布平板培养后,重新挑选单菌落进行液体培养。
- 质粒拷贝数低:由于使用低拷贝数载体引起的质粒DNA提取量低,可以使用更多的菌量但需要相应增加溶液使用量。
- 菌体中无质粒:有些质粒本身不能在某些菌种中稳定存在,经多次转接后有可能造成质粒丢失。例如,柯斯质粒在大肠杆菌中长期保存不稳定,因此不要频繁转接,每次接种时应接种单菌落。另外,检查筛选用抗生素使用浓度是否正确。
- 碱裂解不充分:使用过多菌体培养液,会导致菌体裂解不充分,可减少菌体用量或增加Buffer P1,P2和P3的用量。
- 溶液使用不当:Buffer P2和P3在温度较低时可能出现浑浊,应置于37℃温浴直至溶解,待冷却至室温后使用。
- 吸附柱过载:不同产品中吸附柱吸附能力不同,如果需要提取的质粒量很大,请分多次提取。若用富集培养基(如SOC或SOB)或宿主菌生长率较高,则须减少菌液用量。
- 质粒洗脱不完全:质粒洗脱时,可适当加温(37~60℃)或延长溶解时间,对大质粒效果更为明显。
- 乙醇残留:漂洗液洗涤后应离心尽量去除残留液体,再加入洗脱缓冲液。
- 洗脱液加入位置不正确:洗脱液应加在硅胶膜中心部位以确保洗脱液会完全覆盖硅胶膜的表面达到最大洗脱效率。
- 洗脱液不合适:洗脱效率与洗脱液的pH值有关,如果使用水进行洗脱,请确保其pH>7.0,如果pH过低可能导致洗脱量低,可以用1M氢氧化钠溶液调节水的pH值。
- 洗脱体积太小:洗脱体积对回收率有—定影响。随着洗脱体积的增大回收率增高,但质粒浓度降低。为了得到较高的回收率可以增大洗脱体积。
- 洗脱时间过短:洗脱时间对回收率也会有—定影响。洗脱时放置1分钟可达到较好的效果。如果是低拷贝质粒或质粒大于8kb时,可以分两次洗脱,并且对于大的质粒延长放置时间,让DNA完全溶解后再洗脱,可以提高洗脱效率。
- 溶液失效:Buffer P2长期暴露在空气中容易失效,请每次使用完后,立即盖紧瓶塞,以免失效,造成碱裂解不充分。
- 大肠杆菌老化:请涂布平板培养后,重新挑选单菌落进行液体培养。
- 质粒纯度不高
- 混有蛋白:不要使用过多菌体。经BufferP1,P2和P3处理,离心后溶液应为澄清的,如果还混有微小蛋白悬浮物可再次离心,并延长离心时间,完全沉淀蛋白后再取上清到吸附柱中。
- 混有RNA:RNase A处理不彻底,请减少菌体用量或加入Buffer P3后室温再延长放置时间5~10分钟。如果Buffer P1已保存6个月以上,请在Buffer P1中再添加终浓度为100μg/mL的RNase A。
- 混有基因组DNA:加入Buffer P2后应温和混匀,如果剧烈振荡,可能把基因组DNA打断从而混杂在质粒中。如果加入Buffer P2后过于粘稠,无法温和混匀,请减少菌体用量。细菌培养时间过长会导致细胞内DNA的降解,培养时间不要超过16小时。
- 含大量核酸酶的宿主菌:BL21和HB101等End A+宿主菌含大量核酸酶,在质粒提取和保存过程中可能导致质粒DNA降解,影响提取质粒DNA的完整性,对于这些宿主菌请在操作过程中使用去蛋白液DW1。
- 质粒的二聚体和多聚体形式:质粒复制过程中形成的,与宿主菌相关,电泳可检测出多条条带,单酶切处理后可变成单—条带。
- 混有蛋白:不要使用过多菌体。经BufferP1,P2和P3处理,离心后溶液应为澄清的,如果还混有微小蛋白悬浮物可再次离心,并延长离心时间,完全沉淀蛋白后再取上清到吸附柱中。
- 如何选择最合适的洗脱体积
- SgPrep质粒试剂盒具有优秀的洗脱效率,通常情况下,使用50μL洗脱液进行洗脱,回收率能达到85%,使用小于40μL进行洗脱时,质粒浓度提高,但总得率下降明显,而是用超过100μL洗脱液进行洗脱,质粒得率增加不多,但浓度明显下降。如图所示,用户可以根据自己后续实验的需要进行选择。
通常来说,如果预期质粒产量较低,则使用更少的洗脱液以保证得到的质粒浓度不至于过低,如果预期质粒产量较高,则可以使用更多的洗脱液进行洗脱。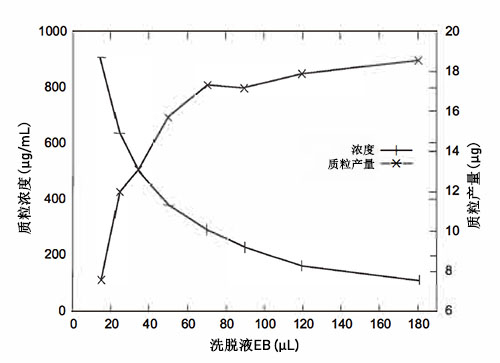
- SgPrep质粒试剂盒具有优秀的洗脱效率,通常情况下,使用50μL洗脱液进行洗脱,回收率能达到85%,使用小于40μL进行洗脱时,质粒浓度提高,但总得率下降明显,而是用超过100μL洗脱液进行洗脱,质粒得率增加不多,但浓度明显下降。如图所示,用户可以根据自己后续实验的需要进行选择。
相关搜索:柱式质粒DNA小量抽提试剂盒(1.5~5mL),柱式质粒小提试剂盒,柱式质粒小量提取试剂盒,柱式质粒提取试剂盒,柱式质粒DNA小提试剂盒,柱式质粒DNA小量提取试剂盒,柱式质粒DNA提取试剂盒,质粒小提试剂盒,质粒小量提取试剂盒,质粒提取试剂盒,质粒DNA小提试剂盒,质粒DNA小量提取试剂盒,质粒DNA提取试剂盒,SgPrep Column Plasmid Mini-Preps Kit(1.5-5mL)



